



알코올성 간질환의 병태생리 및 기초연구
정원일(카이스트 의과학대학원)
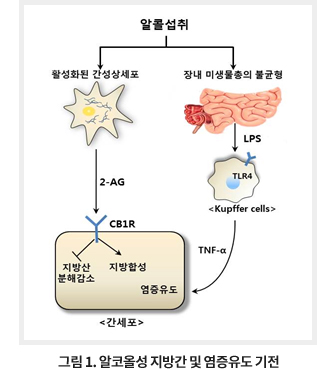 과거의 알코올성 간손상 발생기전은 섭취된 알코올의 약 70%가 alcohol dehydrogenases (ADH)에 의해 나머지 30%가 cytochrome P450 2E1 (CYP2E1)에 의해 acetaldehyde로 변환되며 미토콘드리아에서 마지막으로 acetate로 대사되어 무독화 과정을 거치며 이때 acetaldehyde가 단백질 및 핵산들과 결합해서 이상 생성물을 형성하기도 하고 ROS와 같은 oxidative stress를 야기한다고 보고되었다 . 그러나 최근의 연구 결과에 따르면 단순히 알코올 대사체와 oxidative stress로 알코올성 간질환을 충분히 설명할 수 없으며, 흥미롭게도 간내에 많이 존재하고 있는 다양한 종류의 비실질 세포 (non-parenchymal cell)의 역할에 관심을 가지게 되었다. 간내 약 30~40%에 이르는 비실질 세포들은 쿠퍼세포(Kupffer cell), 간성상세포(Hepatic stellate cell) 및 다양한 면역세포들(선천성 및 후천성 T 임파구들)로 구성되어 있고, 특이하게 설치류와 사람의 간내 임파구들의 약 50%가 선천성 면역을 담당하고 있는 자연살해세포(Natural killer cell), 자연살해 T세포 및 감마델타 T세포로 구성되어있으며 다양한 비실질 세포들이 알코올성 간질환을 포함한 여러 간손상에서 중요한 역할을 수행하는 것으로 알려져 있다 . 따라서, 알코올성 간질환은 알코올에 의해 발생하는 간세포손상 뿐만 아니라 음주로 인한 간내 비실질세포들의 다양한 활성으로 인해 발생하는 것으로 인식되고 있다. 이들 비실질세포들 중 최근에 가장 주목받고 있는 쿠퍼세포(Kupffer cell)와 간성상세포(Hepatic stellate cell)들의 알코올성 간질환(알코올성 지방간 및 지방간염)에서의 역할에 대해서 알아보고자 한다 (그림 1).
과거의 알코올성 간손상 발생기전은 섭취된 알코올의 약 70%가 alcohol dehydrogenases (ADH)에 의해 나머지 30%가 cytochrome P450 2E1 (CYP2E1)에 의해 acetaldehyde로 변환되며 미토콘드리아에서 마지막으로 acetate로 대사되어 무독화 과정을 거치며 이때 acetaldehyde가 단백질 및 핵산들과 결합해서 이상 생성물을 형성하기도 하고 ROS와 같은 oxidative stress를 야기한다고 보고되었다 . 그러나 최근의 연구 결과에 따르면 단순히 알코올 대사체와 oxidative stress로 알코올성 간질환을 충분히 설명할 수 없으며, 흥미롭게도 간내에 많이 존재하고 있는 다양한 종류의 비실질 세포 (non-parenchymal cell)의 역할에 관심을 가지게 되었다. 간내 약 30~40%에 이르는 비실질 세포들은 쿠퍼세포(Kupffer cell), 간성상세포(Hepatic stellate cell) 및 다양한 면역세포들(선천성 및 후천성 T 임파구들)로 구성되어 있고, 특이하게 설치류와 사람의 간내 임파구들의 약 50%가 선천성 면역을 담당하고 있는 자연살해세포(Natural killer cell), 자연살해 T세포 및 감마델타 T세포로 구성되어있으며 다양한 비실질 세포들이 알코올성 간질환을 포함한 여러 간손상에서 중요한 역할을 수행하는 것으로 알려져 있다 . 따라서, 알코올성 간질환은 알코올에 의해 발생하는 간세포손상 뿐만 아니라 음주로 인한 간내 비실질세포들의 다양한 활성으로 인해 발생하는 것으로 인식되고 있다. 이들 비실질세포들 중 최근에 가장 주목받고 있는 쿠퍼세포(Kupffer cell)와 간성상세포(Hepatic stellate cell)들의 알코올성 간질환(알코올성 지방간 및 지방간염)에서의 역할에 대해서 알아보고자 한다 (그림 1).
Kupffer cell은 간내 존재하는 비실질 세포 중 약 20%에 해당하며 탐식작용을 통해서 주로 노폐물의 처리를 담당한다. 특히, 알코올성 간질환의 발생과 진행에 있어서 가장 중요한 역할을 하는 세포로 현재까지 활발한 연구가 이루어져왔다. 만성 음주로 인하여 증가된 microRNA-212들이 장상피세포들의 결합을 저해하여 장내 그람음성균들의 lipopolysaccharide (LPS)가 문맥을 통해 많이 이동하게 되고 간내 Kupffer cell의 Toll-like receptor 4 (TLR4)의 활성을 유도시킨다. Kupffer cell로부터 유도된 TLR4 signal cascade에 의해 Kupffer cell은 IL-1ß, IL-6, TNF-α와 같은 다양한 염증성 cytokine, ROS 및 TGF-ß 와 같은 pro-fibrogenic cytokine들의 생성을 촉진할 뿐만 아니라, 중성호구의 간내 침윤을 증가시킴으로써 더욱 심한 간손상을 유도시키게 된다.
만성적인 음주는 다양한 경로를 통해 간세포의 지방대사 불균형을 초래하여 지방간(alcoholic steatosis, fatty liver)을 유도한다. 특히, 알코올의 섭취에 의해 간세포에서 지방산 생성을 촉진시키는 sterol regulatory element-binding protein 1c (SREBP1c)의 활성은 증가하는 반면, 미토콘드리아에서의 지방산의 분해를 촉진시키는 AMP-activated protein kinase (AMPK)의 활성은 감소됨이 특징적이다. 또한 알코올의 만성적 섭취는 SREBP1c의 발현을 감소시켜주는 STAT3, adiponectin 및 sirtuin1의 발현을 감소시켜서 지방산의 생성을 증가시키게 된다. 최근 연구에 따르면 알코올성 지방간 형성시 엔도카나비노이드(endocannabinoid)의 중요성이 대두되었다. 마리화나(카나비스, cannabis)와 유사한 물질인 엔도카나비노이드는 세포막 지질들이 다양한 효소들에 의해 대사되어 만들어지는 일종의 lipid mediator로서 카나비노이드 수용체인 CB1R와 결합하여 작용을 한다고 알려져 있다. 만성 음주로 인하여 간성상세포 (hepatic stellate cells)에서 엔도카나비노이드인 2-arachidonoylglycerol (2-AG)가 발현 하는것이 확인되었다. 간성상세포는 간세포와 혈관세포 사이의 디쎄 공간 (Space of Disse)에 위치하고 있는 비실질세포들 중 하나이며, 간질환의 진행 특히 간섬유화에 있어서 extracellular matrix (ECM)를 생성하는데 중요한 역할을 하지만 만성 음주시에는 2-AG를 분비함으로써 간세포의 CB1R를 통해 SREBP1c와 fatty acid synthase를 증가시킴과 동시에 AMPK의 활성을 감소시킴으로써 간세포의 지방대사를 교란시켜 결과적으로 알코올성 지방간을 유도하는 것으로 밝혀졌다. 이러한 결과를 바탕으로 CB1R 길항제인 Rimonabant 투여시 간내 지방 침착의 양을 감소시키는 효과를 확인하였으나 우울증과 불안증과 같은 부작용으로 간에서만 특이적으로 CB1R를 차단할수 있는 약물의 개발 혹은 간성상세포에서 2-AG의 합성을 억제할 수 있는 타겟 규명이 필요할 것이다.
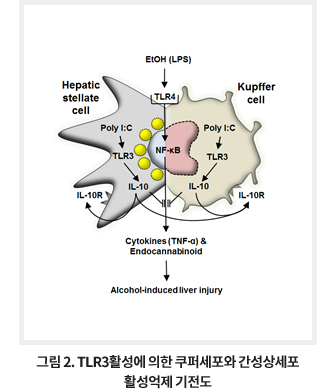 상기에서 기술한 바와 같이 음주로 인한 간질환의 발생과 진행 기전은 그 양상이 매우 복잡하고 다양한 질환을 포괄하며, 간부전의 양상을 보이는 적절한 동물모델이 없기 때문에 연구가 쉽지가 않지만, 알코올성 간염 환자에서 현저하게 증가된 장내 세균과 LPS가 알코올성 간질환에서 중요한 요인이므로 쿠퍼세포(Kupffer cell)에서 LPS/TLR4 신호전달에 의한 염증성 반응들과 간성상세포(hepatic stellate cell)들에 의한 2AG/CB1R 매개 지방증 조절이 매우 중요하다고 할수 있겠다. 따라서 이 두가지 세포들을 동시에 억제할 수 있는 타겟 혹은 물질 개발이 필요한 실정이다. 최근 쿠퍼세포와 간성상세포에서 double strand RNA를 인지하는 TLR3의 활성은 다량의 IL-10의 발현을 유도하게 되고 이를 통해 두 세포들의 활성이 억제되어 알코올성 간질환이 예방될 수 있다는 연구가 보고되어 TLR3에 대한 추가 연구가 필요하다 (그림 2).
상기에서 기술한 바와 같이 음주로 인한 간질환의 발생과 진행 기전은 그 양상이 매우 복잡하고 다양한 질환을 포괄하며, 간부전의 양상을 보이는 적절한 동물모델이 없기 때문에 연구가 쉽지가 않지만, 알코올성 간염 환자에서 현저하게 증가된 장내 세균과 LPS가 알코올성 간질환에서 중요한 요인이므로 쿠퍼세포(Kupffer cell)에서 LPS/TLR4 신호전달에 의한 염증성 반응들과 간성상세포(hepatic stellate cell)들에 의한 2AG/CB1R 매개 지방증 조절이 매우 중요하다고 할수 있겠다. 따라서 이 두가지 세포들을 동시에 억제할 수 있는 타겟 혹은 물질 개발이 필요한 실정이다. 최근 쿠퍼세포와 간성상세포에서 double strand RNA를 인지하는 TLR3의 활성은 다량의 IL-10의 발현을 유도하게 되고 이를 통해 두 세포들의 활성이 억제되어 알코올성 간질환이 예방될 수 있다는 연구가 보고되어 TLR3에 대한 추가 연구가 필요하다 (그림 2).
 중증 알코올성 간질환에 대한 치료제 개발이 힘든 이유 중 하나는 적절한 실험동물의 부재라고 할 수 있겠다. 특히, 마우스에서 사람에서와 같이 만성 음주를 통한 간경변증 및 간암을 유도하기는 매우 어렵지만 적어도 수 주간의 알코올 급여를 통해 사람과 유사한 알코올성 간손상 모델을 구축할 수 있다. 가장 널리 사용되는 알코올 급여 모델은 Lieber-DeCarli 액상식이를 이용하여 4~5% 알코올 식이를 만들어 자유롭게 8주 이상 섭취하도록 함으로써 알코올성 간손상 및 지방간을 유도한다 (그림 3). Lieber-DeCarli 식이법은 가장 널리 사용되는 액상 식이로서, Charles Lieber와 Leonore DeCarli에 의해 1963년 고안된 것으로 마우스가 장기간 알코올 섭취를 할 수 있도록 칼로리 등을 최적화해 놓은 것이다. 그러나 알코올성 지방간 형성외에 알코올 식이 급여만으로는 알코올성 간염은 거의 유도되지 않는다. 최근 보고에 의하면 4-6주 알코올 식이급여와 동시에 경구투여(oral gavage)를 통한 단회 혹은 다회성 알코올 폭음 모델을 결합하면 알코올성 지방간과 간염이 유도되는 NIAAA모델이 개발되었다. 이 방법은 경구 존데의 사용만 익숙해진다면 실험이 비교적 용이하며 기존 방식에 대비하여 마우스에서 간효소치(ALT, AST)의 상승과 지방간을 확실히 유도할 수 있는 장점이 있다. 이 방법은 다양한 방식으로 응용이 가능한데 만성 알코올 급여 기간을 짧게는 10일에서 길게는 8주까지도 연장할 수 있고 알코올 폭음 횟수의 조절을 통해 원하는 정도로 간손상을 유도할 수 있다. 결론적으로 새로운 알코올 급여 방식은 임상적으로, 만성적인 알코올 섭취 환자에서 급성 알코올 섭취로 인해 발생하는 간손상을 마우스 모델에서 재현할 수 있다는 점에서 그 의의를 가질 수 있으며, 이 밖에도 알코올성 간손상 뿐만 아니라 알코올로 인한 기타 장기의 손상 연구에도 응용될 수 있을 것이다.
중증 알코올성 간질환에 대한 치료제 개발이 힘든 이유 중 하나는 적절한 실험동물의 부재라고 할 수 있겠다. 특히, 마우스에서 사람에서와 같이 만성 음주를 통한 간경변증 및 간암을 유도하기는 매우 어렵지만 적어도 수 주간의 알코올 급여를 통해 사람과 유사한 알코올성 간손상 모델을 구축할 수 있다. 가장 널리 사용되는 알코올 급여 모델은 Lieber-DeCarli 액상식이를 이용하여 4~5% 알코올 식이를 만들어 자유롭게 8주 이상 섭취하도록 함으로써 알코올성 간손상 및 지방간을 유도한다 (그림 3). Lieber-DeCarli 식이법은 가장 널리 사용되는 액상 식이로서, Charles Lieber와 Leonore DeCarli에 의해 1963년 고안된 것으로 마우스가 장기간 알코올 섭취를 할 수 있도록 칼로리 등을 최적화해 놓은 것이다. 그러나 알코올성 지방간 형성외에 알코올 식이 급여만으로는 알코올성 간염은 거의 유도되지 않는다. 최근 보고에 의하면 4-6주 알코올 식이급여와 동시에 경구투여(oral gavage)를 통한 단회 혹은 다회성 알코올 폭음 모델을 결합하면 알코올성 지방간과 간염이 유도되는 NIAAA모델이 개발되었다. 이 방법은 경구 존데의 사용만 익숙해진다면 실험이 비교적 용이하며 기존 방식에 대비하여 마우스에서 간효소치(ALT, AST)의 상승과 지방간을 확실히 유도할 수 있는 장점이 있다. 이 방법은 다양한 방식으로 응용이 가능한데 만성 알코올 급여 기간을 짧게는 10일에서 길게는 8주까지도 연장할 수 있고 알코올 폭음 횟수의 조절을 통해 원하는 정도로 간손상을 유도할 수 있다. 결론적으로 새로운 알코올 급여 방식은 임상적으로, 만성적인 알코올 섭취 환자에서 급성 알코올 섭취로 인해 발생하는 간손상을 마우스 모델에서 재현할 수 있다는 점에서 그 의의를 가질 수 있으며, 이 밖에도 알코올성 간손상 뿐만 아니라 알코올로 인한 기타 장기의 손상 연구에도 응용될 수 있을 것이다.


Copyright(c) Korean Endocrine Society. All rights reserved.